Dňa 9. februára 2019 vstúpila do platnosti delegované nariadenie Európskej únie (EÚ) 2016/161 o falšovaných liekoch známe pod skratkou FMD, ktoré stanovilo povinnosť zavedenia systému verifikácie liekov v celej Európskej únii. Slovensko nebolo výnimkou a uplynulo už päť rokov, čo naši lekárnici po úspešnej implementácii podporných IT systémov, príslušných zmenách interných procesov vrátane relevantných edukáciách, začali napĺňať požiadavky horeuvedenej legislatívy a overovať lieky na predpis pri ich výdaji pacientovi.
Základné informácie o FMD a jeho implementácii
Európska únia prostredníctvom Smernice 2001/83/ES Európskeho parlamentu a Rady zo 6. novembra 2001, ktorým sa ustanovuje zákonník spoločenstva o humánnych liekoch, vytvorila legislatívny rámec na zavedenie tzv. bezpečnostných prvkov, ktorými musia byť vybavené vonkajšie obaly liekov na predpis, aby bolo možné prostredníctvom nich identifikovať každé balenie lieku a tak ho odlíšiť od iného balenia toho istého lieku a tiež aby bolo možné ľahko rozpoznať, či nebolo s vonkajším obalom lieku manipulované. Konkrétna technická špecifikácia, ako majú bezpečnostné prvky vyzerať a ako sa majú používať, ako, kedy a kým majú byť použité na verifikáciu balenia lieku a kedy začnú platiť tieto pravidlá pre všetky členské štáty EÚ bolo definované práve v horeuvedenom delegovanom nariadení FMD.
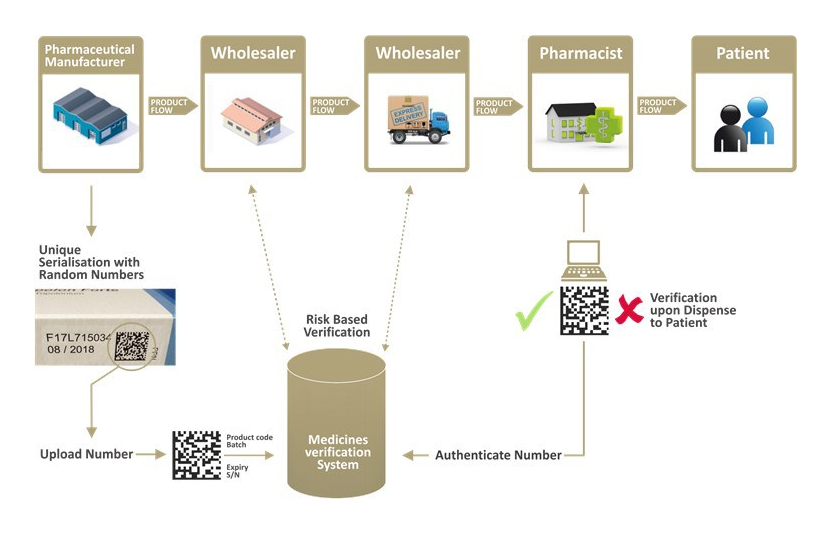
Ťažisko FMD legislatívy teda spočíva najmä v zavedení bezpečnostných prvkov, ktorými musí byť vybavený vonkajší obal balenia lieku na predpis. Bezpečnostné prvky sú dva a to zariadenie na identifikáciu manipulácie s balením – tzv. anti-tampering device a jedinečný špecifický identifikátor balenia, ktorý odlišuje jedno balenie lieku od druhého.
Tieto prvky umožňujú verifikovať balenie lieku pri jeho výdaji pacientovi z hľadiska možného poškodenia vonkajšieho obalu lieku a tiež overiť si, či na vonkajšom obale lieku uvedený špecifický identifikátor skutočne výrobca deklaroval, že ho použil pri výrobe balenia lieku a teda dané balenie vyrobil.
Špecifický identifikátor balenia lieku je umiestnený na vonkajšom obale balenia lieku v dvoch podobách – v strojom čitateľnej podobe (používa sa štandardizovaný 2D kód definovaný štandardizačnou organizáciou GS1) a v človekom čitateľnej podobe. Informácie o špecifických identifikátoroch všetkých balení liekov na predpis dodaných do nášho legálneho distribučného reťazca liekov na predpis je povinný výrobca lieku nahrať do nášho národného verifikačného registra a tento register používajú v súlade s FMD všetky subjekty, ktoré balenie lieku distribuujú a potom vydávajú pacientovi.

V súlade s predmetnou legislatívou pri výdaji balenia lieku pacientovi musí lekáreň, ktorá balenie lieku vydáva, deaktivovať špecifický identifikátor vydávaného balenia lieku vo verifikačnom registri, čím je indikovaná skutočnosť, že balenie bolo pacientovi vydané. Lekáreň je povinná zastaviť výdaj lieku pacientovi, ak sa špecifický identifikátor uvedený na vonkajšom obale vydávaného balenia lieku vo verifikačnom registri nenachádza, alebo je špecifický identifikátor tohto balenia neaktívny.
Verifikačný register je vytvorený v každej EÚ krajine (okrem Talianska a Grécka, ktoré dostali dočasnú výnimku priamo definovanú v FMD) a všetky tieto národné verifikačné registre sú vzájomne prepojené. To umožňuje verifikovať v lekárňach na Slovensku aj balenia liekov na predpis určené pre viaceré krajiny (viacjazyčné balenia ) a tiež balenia liekov určené pre inú EÚ krajinu, ale dodané na náš trh. Inými slovami, lekáreň na Slovensku môže verifikovať a tiež deaktivovať hocijaké balenie lieku na predpis vybavené špecifickým identifikátorom, ktorý je nahraný v ktoromkoľvek verifikačnom registri ktorejkoľvek krajiny EÚ a naopak, ktorákoľvek lekáreň v EÚ môže verifikovať a deaktivovať špecifický identifikátor uložený v našom verifikačnom registri.
Popísaný mechanizmus verifikácie liekov je funkčný na Slovensku a v celej EÚ od 9. februára 2019.
Základné informácie o slovenskom verifikačnom registri
Za národný slovenský verifikačný register, jeho implementáciu, prevádzku a údržbu je zodpovedná Slovenská organizácia pre overovanie liekov – SOOL, čo je v súlade s požiadavkami legislatívy nezisková organizácia, ktorú vytvorili asociácie výrobcov liekov a to Asociácia inovatívneho farmaceutického priemyslu – AIFP a Asociácia pre generické a biosimilárne lieky – GENAS. Ďalším zakladajúcimi členmi sú zástupcovia lekárnikov reprezentovaní Slovenskou lekárnickou komorou a distribútori liekov reprezentovaní Asociáciou veľkodistribútorov liekov AVEL. Všetci pomenovaní zakladatelia a členovia SOOL formovali a dohliadali na implementáciu verifikačného registra a stále majú dohľad nad jeho prevádzkou.
Národný verifikačný register od svojho vzniku poskytuje svoje služby:
- 2 110 Slovenským lekárňam a viac ako 115 000 lekárňam v ďalších krajinách EÚ;
- 115 Slovenským distribútorom liekov a okolo 4 000 distribútorom z iných štátov EÚ;
- 320 výrobcom liekov, ktorí sú reprezentovaní držiteľmi marketingových licencií na lieky (MAH) a ktorí nahrávajú do nášho registra špecifické identifikátory nimi vyrobených balení liekov na predpis určených na slovenský trh;
- ŠUKL je v súlade s legislatívou tiež užívateľom registra a má do neho prístup.
Do národného verifikačného registra od jeho vzniku počas 5 rokov bolo nahraných približne 700 miliónov špecifických identifikátorov balení liekov určených na náš trh. Lekárne deaktivovali – a teda verifikovali – približne 110 miliónov balení liekov ročne. Register je dostupný 365 dní v roku, 24 hodín denne a reaguje každý deň na približne 1 milión požiadaviek od horeuvedených užívateľov. Priemerný reakčný čas na požiadavku je 30 milisekúnd, čo je hlboko pod požiadavkou legislatívy, ktorá je 300 milisekúnd.
Prínosy verifikačného systému liekov po 5 rokoch
Implementácia FMD výrazne prispela k zvýšeniu bezpečnosti pacientov na Slovensku. Lekárne, ktoré vydávajú lieky pacientom, majú teraz väčšiu istotu, že vydávané lieky na predpis sú autentické a prešli dôkladným overovaním. Taktiež tento systém vniesol viac transparentnosti do distribučných procesov liekov. Celý paneurópsky verifikačný systém liekov, ktorého sme súčasťou, predstavuje významný preventívny prvok, ktorý zásadnou mierou bráni falšovateľom liekov pokúšať sa dostať ich falšované lieky do oficiálneho distribučného reťazca liekov.
Jedným z dôležitých hmatateľných výsledkov systému je zachytenie falšovaných balení liekov -konkrétne balení onkologického lieku Imbruvica – v našom legálnom distribučnom reťazci liekov. ŠUKL na základe tejto skutočnosti siahol celú šaržu predmetného lieku (v ktorej sa falošné balenia našli) z trhu v roku 2021 (viď informácia na stránke www.sukl.sk zo dňa 16.12.2021).
Výzvy a ďalší rozvoj verifikačného systému liekov
Hoci FMD priniesla mnoho výhod, existujú aj výzvy, ktorým je potrebné čeliť. Medzi tieto patrí nákladová záťaž spojená s implementáciou tejto legislatívy či už na strane výrobcov liekov, tak aj na strane lekární a tiež distribútorov liekov.
Ďalšou výzvou je neočakávané množstvo technických incidentov, ktoré sú generované vo verifikačnom systéme a sťažujú život lekárnikom a následne aj výrobcom liekov. Historicky najvyšší počet incidentov od začiatku spustenia systému bol zaznamenaný v druhom aprílovom týždni roku 2019, v ktorom sa počet incidentov za týždeň vyšplhal na viac ako 17 000. Najčastejšie dôvody vzniku sú problémy s nastavením čítačiek špecifických identifikátorov balení v lekárňach, v dôsledku čoho sú interpretované chybne. V prvom roku spustenia verifikačného systému bolo týždenne zaznamenaných v priemere takmer 8500 incidentov spôsobených slovenským užívateľom. Našťastie v tomto sa za ostatné dva roky podarilo aj v spolupráci s viac ako 40 dodávateľmi lekárenských a distribučných IT systémov zjednať nápravu. Do roku 2021 došlo k výraznému poklesu vzniku incidentov a v roku 2022 boli počty stabilizované. Pre porovnanie, v roku 2023 bolo týždenne zaznamenaných v priemere 330 incidentov spôsobených slovenským užívateľom. Momentálne Slovensko vykazuje najmenšiu mieru chybovosti čítania špecifických identifikátorov z celej EÚ.
Perspektívy do budúcnosti zahŕňajú ďalší vývoj technológií, ktoré môžu zvýšiť efektívnosť FMD, ako aj ďalšie možnosti využitia tohto systému v prospech pacientov, ako je napríklad možnosť monitorovania výpadku liekov prostredníctvom tohto systému. Skutočnosť, že balenie lieku je jednoznačne identifikovateľné, otvára priestor lekárňam a tiež distribútorom zlepšiť manažment pohybu balenia lieku v ich skladovom hospodárstve. Tu by výrazne pomohlo zavedenie tzv. agregačnej funkcionality do systému. Samozrejme takéto možnosti, ak presahujú terajší rámec legislatívy musia byť podporené príslušnými zmenami tejto legislatívy.
Záver
Piata výročie implementácie FMD na Slovensku je vhodnou príležitosťou na hodnotenie pozitív a výziev implementácie tohto systému. Bezpečnosť pacientov, ďalšia významná preventívna bariéra pre falšovateľov liekov ako aj efektívnejšie monitorovanie distribúcie liekov na predpis sú kľúčovými výhodami tohto systému. Treba vyzdvihnúť prínos všetkých zainteresovaných strán pri úspešnej implementácii a 5-ročnej prevádzke tohto systému. Treba vyzdvihnúť prístup lekárnikov k uvedenej legislatíve, ktorí po počiatočnej nedôvere k fungovaniu takéhoto systému a po uvedomení si užitočnosti tohto prvku ochrany pacienta, adaptovali svoje vnútorné procesy v súlade s legislatívou. Tu im výrazne pomohli aj dodávatelia ich IT lekárenských systémov, ktorí implementovali do týchto systémov funkcionality potrebné pre napĺňanie požiadaviek legislatívy. Poďakovať za plnú funkčnosť verifikačného systému na Slovensku treba však aj zástupcom MZ SR a zástupcom ŠÚKL, ktorí metodickým vedením a príslušnými usmerneniami napomáhali úspešnému implementačnému procesu vrátane transformáciou FMD do našej lokálnej legislatívy. Poďakovanie patrí aj distribútorom liekov, ktorí najmä svojim súhlasom nad rámec FMD kontrolovať dodávané balenia lekárňam s cieľom zabrániť distribúcii balení liekov, ktoré nemajú nahraté svoje špecifické identifikátory vo verifikačnom registri, zabránili mnohým technickým incidentom v systéme. Vyzdvihnúť v neposlednom rade treba výrobcov liekov, ktorí niesli a nesú najväčšiu záťaž spojenú s implementáciou a prevádzkou tohto systému. Koordináciu pri implementácii a tiež prevádzku verifikačného registra zabezpečuje spomínaná organizácia SOOL, ktorá túto úlohu zvládla a zvláda na dobrej úrovni.
Na zvládanie výziev a zabezpečenie trvalo udržateľného systému v boji proti falšovaným liekom je neustále potrebné hľadať inovatívne riešenia a v tomto SOOL bude naďalej pokračovať. To sa dá však len vtedy, ak bude fungovať otvorený dialóg medzi všetkými zainteresovanými stranami vrátane lekární, s cieľom neustále zlepšovať a prispôsobovať sa dynamike farmaceutického priemyslu, dynamike distribučného systému liekov a prudko sa rozvíjajúcemu technologickému prostrediu s cieľom napĺňať očakávanie verejnosti ohľadom bezpečnosti liekového reťazca.
Ing. Roman Guba

